Krebsforschung - wie Stammzellbiologen bösartige Tumore besiegen wollen
Profil des Wissenschaftlers
 Andreas Trumpp leitet seit 2008 die Abteilung „Stammzellen und Krebs“ am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg.
Andreas Trumpp leitet seit 2008 die Abteilung „Stammzellen und Krebs“ am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg.
Nach dem Diplom in Biologie promovierte Trumpp (Jahrgang 1964) am European Molecular Biology Laboratory (EMBL) über molekulare Entwicklungsbiologie. Von 1994 bis 2000 arbeitete er im Labor des Nobelpreisträgers Prof. Michael J. Bishop in San Francisco. 2000 wechselte er an das Schweizerische Institut für Experimentelle Krebsforschung bei Lausanne und wurde 2005 Professor für Stem Cells and Oncology an der EPFL Lausanne.
Seit 2008 ist er auch Geschäftsführer des Heidelberger Instituts für Stammzelltechnologie und Experimentelle Medizin (HI-STEM gGMBH), das Forschungsergebnisse in klinische und industriell verwertbare Produkte überführen soll.
Pressebericht
Den Pressebericht im Lauffener Bote finden Sie hier
Bild der Wissenschaft interviewt ...
 "Ich baue auf individuelle Krebsbehandlung": Trotz aller medizinischen Fortschritte stirbt bislang jeder zweite Krebspatient an seiner Krankheit. Der Stammzell-Forscher Andreas Trumpp ist überzeugt, dass Krebs bald viel von seinem Schrecken verlieren wird.
"Ich baue auf individuelle Krebsbehandlung": Trotz aller medizinischen Fortschritte stirbt bislang jeder zweite Krebspatient an seiner Krankheit. Der Stammzell-Forscher Andreas Trumpp ist überzeugt, dass Krebs bald viel von seinem Schrecken verlieren wird.
bild der wissenschaft: „Durchbruch in der Krebs-Grundlagenforschung“ hieß es in bild der wissenschaft, als wir im Mai 2009 über Ihren Ansatz berichteten, bösartigen Stammzellen auf die Schliche zu kommen. Ist das Wort Durchbruch immer noch gerechtfertigt, Herr Prof. Trumpp?
Andreas Trumpp: Bei dem Wort Durchbruch denken viele an einen Sieg über alle Arten von Krebs. So weit sind wir leider noch nicht, obwohl es bei einigen Krebsarten wie der chronischen myeloischen Leukämie enorme Fortschritte gegeben hat: Hier liegt die Überlebensrate heute weit über 90 Prozent. In den letzten Jahren konnten Krebsstammzellen nicht nur bei dieser Leukämie, sondern auch bei sehr vielen anderen Tumorarten identifiziert werden. Wir wissen inzwischen auch, dass Krebsstammzellen durch herkömmliche Therapien nur unzureichend abgetötet werden. Überlebende Krebsstammzellen sind daher vermutlich auch die Ursache dafür, wenn der Krebs nach einiger Zeit wieder aufflammt oder Metastasen bildet. Dass die Krebsstammzellen relativ unempfindlich gegenüber gängigen Therapien sind, liegt wohl an ihrer Fähigkeit, in zeitweise tiefe Ruhephasen abzutauchen.
Was ist zu tun?
Unsere Forschungsgruppe am Deutschen Krebsforschungszentrum (DKFZ) und meine Mitarbeiter am neuen Stammzellinstitut HI-STEM, das sich auch im DKFZ befindet, versuchen die ruhenden und unempfindlichen Stammzellen aufzuwecken – etwa durch Interferon-alpha und weitere Faktoren. Die Idee dahinter ist, dass die aufgeweckten Krebsstammzellen beginnen, sich zu teilen, was sie hochempfindlich gegenüber einer Chemotherapie macht. Auch andere Krebsforscher, zum Beispiel in den USA und Japan, versuchen wie wir, Krebsstammzellen in einem zweistufigen Verfahren anzugreifen: erst aufwecken, dann abtöten.
Könnte man die Krebsentstehung dadurch verhindern?
Krebszellen entstehen durch eine Anhäufung von Genveränderungen, sogenannten Mutationen, in einer einzelnen Körperzelle. Man weiß heute, dass sich je nach Krebsart 10 bis 20 Mutationen in der gleichen Zelle schrittweise anhäufen. Die ersten Mutationen können bereits im Fötus auftreten, und weitere Mutationen setzen dann einen kontinuierlichen langwierigen Prozess in Gang, bei dem über ungefährliche Vorstufen ein kleiner gutartiger Tumor heranwächst. Weitere Veränderungen führen dann zu einem gefährlichen Karzinom, das sich schließlich zügig zu einem metastasierenden bösartigen Krebs weiterentwickelt. Der gesamte Prozess dauert in der Regel viele Jahrzehnte. Daher ist Krebs auch eine typische Alterskrankheit. Die Anhäufung von Mutationen ist zufallsgesteuert. Wer sich allerdings häufig in die pralle Sonne legt, raucht oder sich anderen Giften aussetzt, kann die Mutationshäufigkeit, und damit die Wahrscheinlichkeit, an Krebs zu erkranken, drastisch erhöhen.
Hier ist also jeder seines eigenen Glückes Schmied?
Ja. Doch selbst wer solche Gefahren meidet, muss mit Mutationen rechnen. Wir besitzen in unserem Körper etwa hundert Billionen Zellen, von denen sich viele ständig erneuern. Bei jeder Zellteilung muss das gesamte Erbgut verdoppelt werden, ähnlich wie bei einer Computer-Datei mit zwei Milliarden Zeichen. Obwohl dies nahezu perfekt funktioniert, kommt es bei der enormen Gesamtzahl doch immer zu einigen Fehlern, sprich Mutationen. Allerdings finden nur wenige davon in der gleichen Zelle statt, sodass Krebs bei jüngeren Menschen doch selten ist und eben vor allem im Alter auftritt.
Einige Mediziner hoffen, ums Jahr 2020 die meisten Krebsarten so weit im Griff zu haben, dass sie als chronische Erkrankungen behandelt werden können. Hoffen Sie das auch?
Da bin ich sehr optimistisch. Das in Angriff genommene Krebsgenom-Projekt wird entscheidend zur Entschlüsselung der individuellen Kombination der Mutationen in jedem Krebspatienten beitragen. Und die Krebsstammzell-Forschung wird wichtige Aufschlüsse bringen, wie und warum es immer wieder zur Metastasenbildung kommt. Das eigentliche Problem einer Krebserkrankung sind die Metastasen: Da besteht nach heutigem Wissensstand kaum eine Möglichkeit der Heilung. Studien der Johns Hopkins University in Baltimore zeigen, dass es 20 bis 30 Jahre dauert, ehe aus den ersten veränderten Zellen bösartige Metastasen werden. Wer heute mit einem Karzinom zum Arzt kommt, trägt statistisch gesehen schon über 20 Jahre Krebszellen in sich herum. Die Behandlung zu diesem späten Zeitpunkt ist im Moment sehr schwierig – und daran wird sich wenig ändern. Doch es gibt eine Chance zur Früherkennung. Wenn die Tumore sehr klein sind und wenige Mutationen tragen, sind sie relativ leicht zu bekämpfen. Bei bestimmten früh erkannten Brustkrebsarten liegt die 10-Jahre-Überlebensrate bei 90 Prozent. Auch bei Darmkrebs lohnt sich die Früherkennung. Eine Studie, die bei uns am DKFZ erstellt wurde, belegt eindeutig: Wenn man während einer Darmspiegelung Darmpolypen – gutartige Tumoren – entfernen lässt, sinkt die Wahrscheinlichkeit, später an Darmkrebs zu erkranken, um rund 80 Prozent.
Das spricht eindeutig für die Krebsvorsorge. Doch es gibt Zweifler, die gegenrechnen, dass Ängste und falsch angewandte Therapien, die durch Vorsorge-Resultate ausgelöst werden, ebenfalls Leben verkürzen oder gar kosten. Wie beurteilen Sie das?
Jede Untersuchung birgt gewisse Risiken, bei der Darmspiegelung im mittleren Alter überwiegen die Vorteile die Risiken aber bei Weitem.
Wie lebt man als Molekularbiologe, der sich tagtäglich mit der weltumspannenden Geißel Krebs auseinandersetzt? Ängstigt man sich mehr als andere vor einer Erkrankung?
Ich persönlich bin nicht der Charakter, der ängstlich ist. Dennoch bewegen mich die Schicksale. Beispielsweise arbeiten wir mit Brustkrebspatientinnen zusammen, deren Erkrankung im Endstadium ist. Einerseits stimmt deren Schicksal traurig. Andererseits sind es gerade diese Patientinnen, die uns Forschern ermöglichen, zukünftigen Erkrankten zu helfen.
Sie treffen mit diesen Patientinnen zusammen?
Nein, normalerweise nicht. Wir bekommen nur Blut- und Gewebeproben. Seit über einem Jahr arbeiten wir mit dem Team von Prof. Andreas Schneeweiss am Nationalen Zentrum für Tumorerkrankungen in Heidelberg zusammen, um insgesamt 600 metastasierte Brustkrebspatientinnen auf zirkulierende Krebsstammzellen im Blut zu untersuchen. Eine Patientin mit Knochenmetastasen hatte die riesige Zahl von 100 000 Tumorzellen in sieben Milliliter Blut! Auch wenn es sich makaber anhört: Für die Forschung war das ein Glücksfall, weil wir mit dieser großen Zahl an zirkulierenden Tumorzellen viele Experimente parallel durchführen konnten, und wir dadurch einen neuen Rezeptor auf der Oberfläche der zirkulierenden Krebszellen identifiziert haben. Interessanterweise entwickeln eine Reihe von Pharmafirmen zurzeit aus anderen Gründen Hemmstoffe, sogenannte Inhibitoren, gegen diesen Rezeptor. Diese könnten möglicherweise bei Brustkrebspatientinnen, bei denen mit Knochenmetastasen zu rechnen ist, eingesetzt werden.
Wie viele Erkrankte brauchen Sie in der Regel, um weiterzukommen?
Das kommt auf die Fragestellung an. Doch es müssen schon mehrere sein. Schon deshalb, weil nicht jeder Brustkrebs gleich ist. Es gibt mindestens fünf Untergruppen, die sich durch die Kombination an Mutationen unterscheiden und wahrscheinlich auch in der Ursprungszelle, von der der Tumor ausging. Das ist auch der Grund dafür, dass eine bestimmte Chemotherapie oft nur bei der Hälfte der Patienten anspricht. Wenn wir beginnen, das Erbgut der Krebszellen der Patienten zu entschlüsseln, wird sich das hoffentlich ändern: Vielleicht schon in fünf Jahren wird man vorhersagen können, wer überhaupt auf eine bestimmte Chemotherapie anspricht. Allen anderen Patienten kann man die Nebenwirkungen ohne medizinischen Nutzen ersparen und sie stattdessen mit Therapien behandeln, von denen sie auch wirklich profitieren.
Chemotherapie ist weiterhin unumgänglich?
Wir werden mittelfristig nicht darauf verzichten können. Wir brauchen wirksame Medikamente, um die Masse des Tumors rasch schrumpfen zu lassen. Die modernen zielgerichteten Therapien sind zwar sehr spezifisch, wirken typischerweise aber am besten in Kombination mit klassischen Chemotherapien.
Was hoffen Sie, in Ihrer aktiven Zeit als Krebsstammzell-Forscher noch zu erleben?
Ich baue darauf, dass sich in den kommenden fünf bis zehn Jahren das Krebsgenom eines jeden Patienten sofort entschlüsseln lässt und wir beginnen können, die meisten Krebserkrankungen individuell zu behandeln. Ich baue weiter darauf, dass für die etwa 15 wichtigen Signalwege der Krebsentwicklung Inhibitoren zur Verfügung stehen werden, um für jeden Patienten wie aus einem Baukastensystem eine optimale Behandlung zusammenstellen zu können. Und ich hoffe, zusammen mit meinen Stammzell-Kollegen im In- und Ausland, Substanzen und Therapien entwickeln zu können, die Krebs- und Metastasen-Stammzellen effektiv angreifen. Damit verfolgen wir das ehrgeizige Ziel, die Zahl der Rückfälle drastisch zu verringern und Metastasen endlich erfolgreich zu bekämpfen. Ich hoffe auch, dass die Früherkennung von Krebs weiter verbessert wird, denn frühe Tumoren mit weniger Mutationen sind viel leichter zu bekämpfen als solche, die bereits die ganze Palette an Gen-Veränderungen in sich tragen. Diese Entwicklungen würden einen rasanten Fortschritt bedeuten. Ich bin guter Dinge miterleben zu können, dass Menschen mit Krebs deutlich länger und auch besser leben als heute.
Das Gespräch führte Wolfgang Hess für bild der wissenschaft 7/2011
Bildnachweise
Portrait Prof. Andreas Trumpp: V. Steger
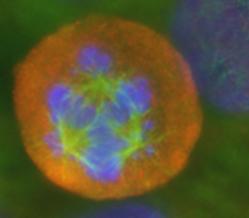
Foto Krebszelle: DKFZ
Fehler bei der Zellteilung können zu Krebs führen: Hier die mehrpolige, missgebildete Spindel einer Krebszelle.




